Notícias
Na descrição dos diagramas de fase a variável tempo não foi considerada. É claro que todas as transformações requerem um intervalo de tempo para se completarem. Portanto, se a aproximação ao estado de equilíbrio for representada numa escala temporal, pode-se obter uma representação tridimensional básica, conforme mostra a figura abaixo.
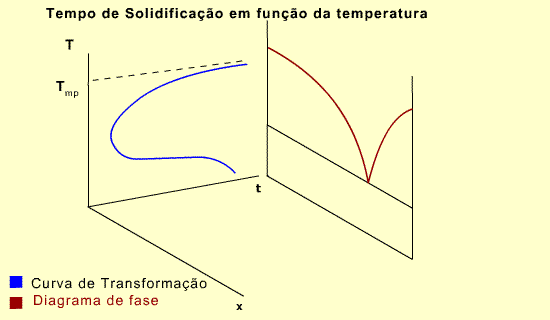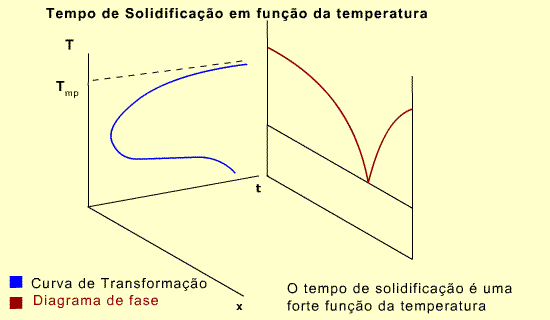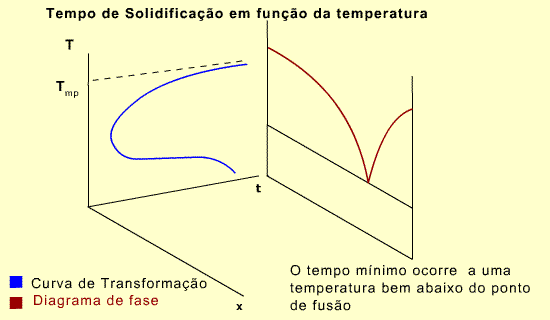
Observe que o eixo de tempo é perpendicular ao plano temperatura-composição. Para o componente A, o diagrama de fase mostra que A na fase sólida pode existir em qualquer temperatura abaixo do ponto de fusão. Porém, o tempo necessário para a transformação da fase líquida para sólida é fortemente dependente da temperatura. Em outras palavras, o tempo necessário para a completa solidificação é dependente da temperatura.
A forma de joelho da curva significa que a reação de solidificação é lenta em temperaturas próximas ao ponto de fusão e em baixas temperaturas. É mais rápida em temperaturas intermediárias.
Para entender este comportamento vamos analisar a precipitação de um sólido de fase única numa matriz líquida (ver figura abaixo).
O processo de precipitação ocorre em dois estágios:
- Nucleação - a nova fase, mais estável, aparece inicialmente como pequenos núcleos, resultantes de flutuações atômicas locais, e contém algumas centenas de átomos. Muitos núcleos são produzidos aleatoriamente. Somente os núcleos maiores que um determinado tamanho são estáveis e continuam crescendo.Na temperatura de fusão existe equilíbrio entre as fases, portanto não há força para impulsionar a transformação. Abaixo da citada temperatura, cria-se instabilidade que promove o rápido aumento da taxa de nucleação. O crescimento não continua indefinidamente.
- Uma redução mais significativa da taxa de crescimento dos núcleos ocorre novamente com a redução da temperatura. A junção dos átomos para formar núcleos é um processo de difusão localizado.
- A maior taxa ocorre num campo de temperaturas onde as forças que promovem a solidificação e a difusão são grandes.
Gostou? Então compartilhe:
Notícias relacionadas
