Notícias
O estudo dos sistemas de um só componente está subordinado às variáveis temperatura e pressão, uma vez que a concentração, evidentemente, é invariável.
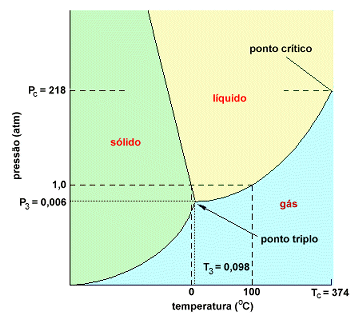
A forma geral do diagrama unário está esquematizada na figura abaixo. O equilíbrio de uma única fase é representado por uma área ou domínio de fase. Nestes domínios, o sistema é divariante, ou seja, F = 2. Isto significa que a pressão e a temperatura podem ser alteradas, independentemente e arbitrariamente, contanto que não modifiquem o número de fases do sistema.
O equilíbrio entre as duas fases é representado por linhas ou curvas. Isto pode ser facilmente deduzido da regra das fases. O sistema é aí univariante.
Note-se ainda que as três fases só podem coexistir em equilíbrio para temperatura e pressão determinadas, definindo um ponto no diagrama, denominado ponto tríplice. Neste ponto o sistema é invariante já que F = 0.
Um diagrama de fase completo de um sistema binário, representando o efeito da variação dos três fatores externamente controláveis - pressão, temperatura e composição - requer o uso de um modelo tridimensional.
Como normalmente as operações metalúrgicas são realizadas a pressão atmosférica, usa-se, por conveniência, um diagrama bidimensional temperatura & composição, denominado condensado. Esse diagrama é simplesmente uma seção do diagrama tridimensional, tomando a pressão constante de uma atmosfera. Neste caso, o número de variáveis fica reduzido a dois, e a lei de Gibbs tem a forma.
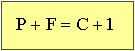
já que um grau de liberdade foi usado para especificar a pressão.
Sob estas circunstâncias, a coexistência de três fases em um diagrama binário produz uma condição invariante, enquanto a coexistência de duas fases produz uma condição bivariante.
A representação do diagrama binário condensado é feita normalmente tomando-se a ordenada como temperatura e a abscissa como concentração dos dois componentes A e B, onde B varia de 0% a 100% e A varia, de 100% a 0% no sentido da esquerda para a direita.
Os materiais formados por dois componentes podem ser constituídos: de uma solução sólida com um componente completamente miscível no outro; de uma mistura dos componentes, com ausência ou parcialidade de solubilidade, mas sem reações químicas envolvidas; e ainda pela presença de novos compostos. Estas diferenças de comportamento devem-se a:
Logo podemos classificar os diagramas binários como:
Gostou? Então compartilhe:
Notícias relacionadas
Faça seu login
Ainda não é cadastrado?
Cadastre-se como Pessoa física ou Empresa
