Notícias
- Material Didático
- Materiais - FundamentosFormando os Materais
COMO OS ÁTOMOS SE ARRANJAM?
Imagine um monte de bolas de gude em uma caixa de sapato. Esta era a forma padrão de como as estruturas eram visualizadas antes do computador. As bolas tendem a ficar arranjadas de forma a melhor ocupar o espaço. Este arranjo é chamado empacotamento compacto – você também pode comparar este arranjo ao de uma pilha de laranjas no supermercado: note como as laranjas formam um padrão. Cada laranja rotulada de A estará rodeada por seis outras laranjas em uma mesma camada. Veja os "furos" (espaços vazios) chamados B e C. Podemos colocar uma segunda camada de laranjas empacotadas compactamente tanto sobre as posições B como sobre as posições A (mas não ao mesmo tempo!). Desta forma, podemos construir uma estrutura em 3D.
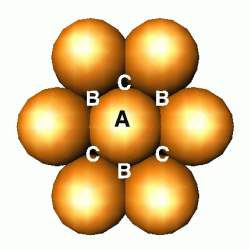
EMPACOTAMENTO COMPACTO
Esta estrutura corresponde a alguma coisa na natureza (além das laranjas no supermercado)?
Uma pilha de camadas do tipo ABC.ABC... representa a estrutura atômica cúbica de empacotamento compacto, que o ouro possui conforme determinado por raios-X. Átomos estão colocados nos vértices de um cubo, com átomos adicionais nos centros de cada face do cubo: por esta razão esta estrutura é normalmente conhecida por cúbica de face centrada ou cfc. Muitos metais tem esta estrutura, tais como o alumínio e o cobre.
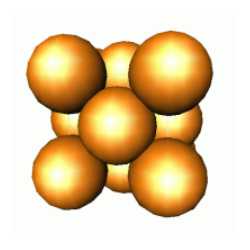
ESTRUTURA CÚBICA DE FACE CENTRADA DO OURO
Na verdade existe uma segunda forma bastante comum de empacotamento compacto, correspondente a camadas empilhadas do tipo AB.AB... ou AC.AC...(são equivalentes). Esta estrutura é chamada hexagonal compacta, hc , e a competição entre cfc e hc, é determinada pelas forças de longo alcance existentes entre os átomos. Esta é a estrutura da prata! Não, não podemos transformar prata em ouro forçando um empilhamento diferente. Para estes materiais (como para outros), as propriedades diferentes são devidas principalmente as diferenças existentes entre os átomos de ouro e de prata.
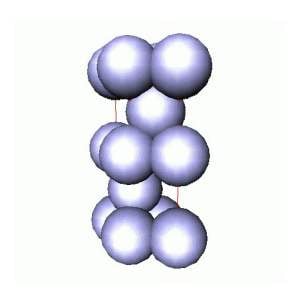
ESTRUTURA HEXAGONAL COMPACTA DA PRATA
Há ainda uma terceira estrutura muito comum entre os metais: a chamada cúbica de corpo centrado, ccc. Esta consiste em um cubo unitário (célula unitária genericamente, pois como visto acima no caso do hexágono, pode não ser um cubo!) com átomos em seus vértices e um átomo em seu centro. A estrutura ccc é ligeiramente menos compacta que as estruturas cfc e hc. Existem metais, como o ferro, que mudam de estrutura cristalina com o aumento da temperatura: o ferro é ccc desde a temperatura ambiente até 910 °C, quando então passa a ser cfc. Se continuarmos a aquecer, o ferro novamente muda de estrutura cristalina voltando a ser ccc a partir de 1396 °C e mantém esta estrutura até sua fusão (~ 1536 °C). Diz-se que metais como o ferro, sofrem transformações alotrópicas de fase no estado sólido. Metais como o cromo, são sempre ccc.
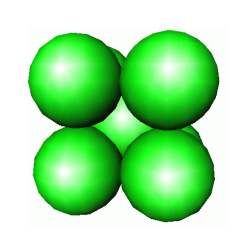
ESTRUTURA CÚBICA DE CORPO CENTRADO DO CROMO
Os metais que são ccc, como o cromo, normalmente são mais duros e menos maleáveis que os metais com estruturas compactas, como a prata e o ouro. Quando o metal é deformado, os planos de átomos podem escorregar uns sobre os outros, e isto é mais difícil nas estruturas ccc como veremos adiante. Existem também outros mecanismos importantes para o endurecimento dos metais,que envolvem a introdução de impurezas ou defeitos, que também bloqueiam o escorregamento.
Humm. Está tudo muito bem, pois eu só tenho um tipo de átomo. O que acontece quando eu tenho dois ou mais diferentes tipos de átomos? Vamos ver o que acontece em um sal.
Gostou? Então compartilhe:
Notícias relacionadas
