Notícias
Fonte e arte: CIMM
Um metal no estado sólido possui átomos que vibram com uma certa freqüência em torno de posições geométricas definidas, determinadas pelo tipo de arranjo cristalino específico do metal.
No estado líquido, esses átomos além de vibrarem não possuem posição definida, pois estão em movimento. Por se movimentarem, os átomos no estado líquido entram em colisão, envolvendo milhares de átomos simultaneamente.
Nesta colisão surge um agrupamento momentâneo de átomos, formando um núcleo com um dado arranjo atômico (CCC, CFC, HC, etc). O núcleo é um sólido que pode crescer ou se dissolver, dependendo da temperatura do sistema.
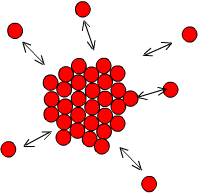 Para crescer, os átomos migram do liquido para o sólido, acoplando-se em posições de equilíbrio do reticulado que é específico de cada metal, conforme indicado na figura.
Para crescer, os átomos migram do liquido para o sólido, acoplando-se em posições de equilíbrio do reticulado que é específico de cada metal, conforme indicado na figura.
A temperatura na qual ocorre equilíbrio termodinâmico entre um sólido e seu respectivo líquido é chamada de temperatura de fusão. Em substâncias puras e sistemas eutéticos, essa temperatura é igual à de solidificação.
O estudo da solidificação envolve duas abordagens distintas. Na abordagem termodinâmica, analisam-se as energias envolvidas na solidificação enquanto na abordagem cinética, analisa-se a velocidade com que os processos (de nucleação e crescimento) acontecem.
Aqui será tratada a abordagem termodinâmica.
Temperatura na Solidificação
A solidificação é composta dos processos de nucleação e crescimento de cristais a partir de um líquido. Ocorre no resfriamento, conforme curva de temperatura abaixo.
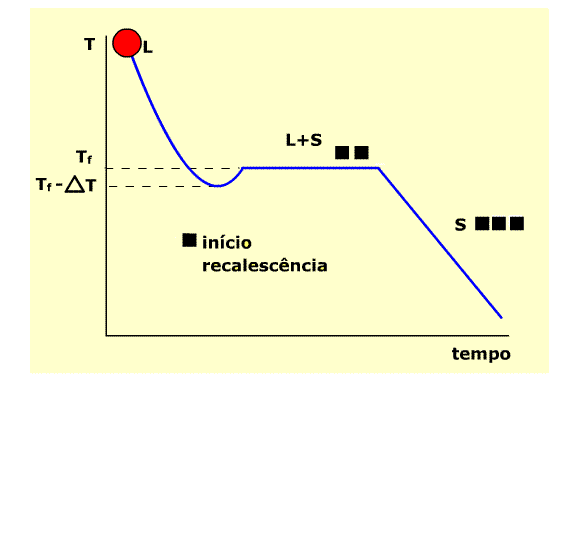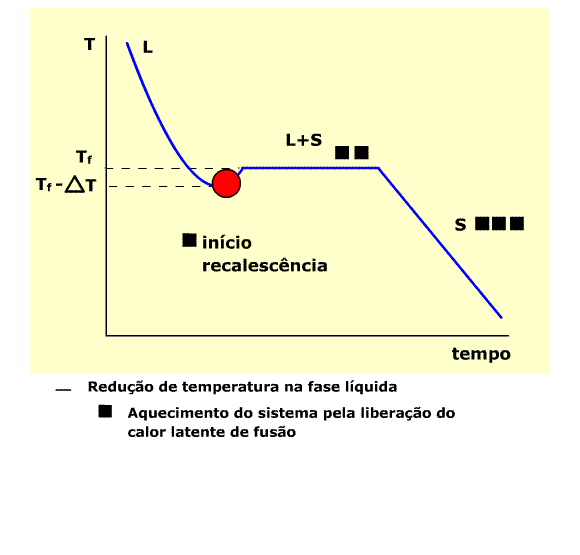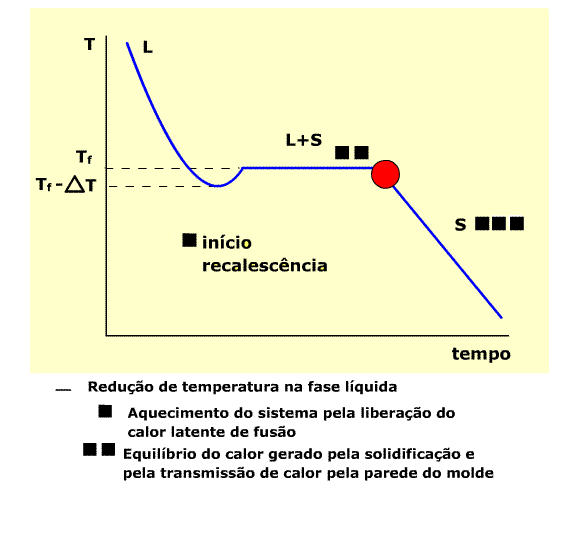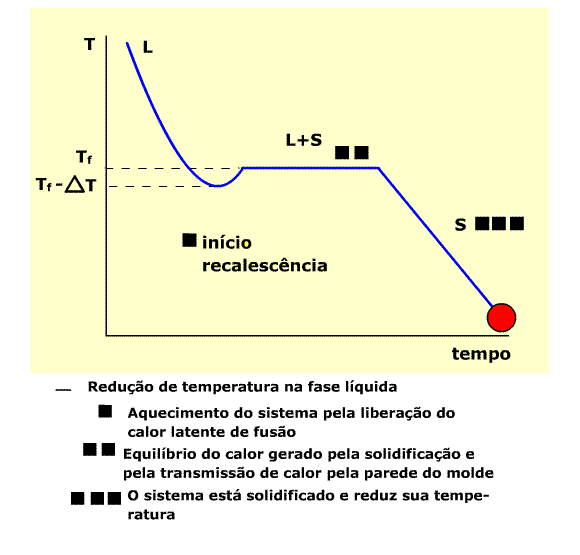
Curva típica de temperaturas de resfriamento
Na região L (estado líquido) , a temperatura diminui por efeito de transmissão de calor através do molde. A temperatura aumenta a Partir de Tf -DT pelo efeito de rescalescência. Inicia-se a solidificação, através do aparecimento dos primeiros núcleos sólidos. No patamar L+S há a coexistência dos estados líquido e sólido. Ao final do patamar toda a massa está solidificada ( início da região S).
Note que a solidificação se inicia numa temperatura situada no intervalo DT, portanto o líquido se encontra abaixo da temperatura de fusão ( Tf ), super-resfriado.
Balanço de Energia - Energia de Gibbs
Em sistemas sob pressão e temperatura constantes, a energia controladora do processo é a energia livre de Gibbs (G).
Tal energia é definida por
G = H -TS
onde T é a temperatura, H é a entalpia e S a entropia da substância em questão.
A entalpia pode ser entendia fisicamente como uma medida da quantidade de calor existente na substância e a mesma é “estocada” na forma de amplitude de vibração dos átomos. Portanto, a medida da entalpia (unidades de energia) reflete uma medida da energia de ligação entre os átomos.
Já a entropia pode ser entendida como uma medida da desorganização interna da substância, isto é, uma medida de como os átomos se arranjam. Em um líquido, os átomos se arranjam de modo desordenado enquanto em um sólido, há maior ordenação (menor entropia), pois os átomos ocupam posições regulares (formando o reticulado cristalino CCC, CFC e outros).
Sabe-se que no universo a energia é constante e que a variação da entropia é igual ou maior que zero (tendência à desordem). A energia de Gibbs é portanto um parâmetro indicador da estabilidade em sistemas sob temperatura e pressão constantes. O sistema tende a seu estado de mínima energia livre.
Para o caso de transformação de fases numa substância, trabalha-se com a variação da energia livre DG , na forma:
DG= G sólido – G líquido ou DG = DH-TDS
onde DH é a variação de entalpia e DS é a variação de entropia entre os estados da transformação (líquido e sólido).
Como conseqüência do fato de que o sistema (sob temperatura e pressão constantes) tende a evoluir no sentido de minimizar a energia livre de Gibbs, temos que a variação desta energia (DG) é um valor que indica o sentido espontâneo de uma reação (quando o sistema se encontra sob temperatura e pressão constantes), de acordo com:
- se DG > 0 : reação impossível (não ocorre)
- se DG = 0 : reação em equilíbrio
- se DG < 0 : reação pode ocorrer (sentido espontâneo)
Além do aspecto de que o valor de DG indica a tendência de reação , tal valor é uma medida da energia disponível para que ocorra a reação, podendo ser interpretado como a força motriz da transformação. Quanto mais negativo for DG, maior a força motriz e maior a tendência de ocorrer a reação.
Termodinâmica da Nucleação
O objeto deste enfoque é a energia envolvida no processo, particularmente a força motriz e a barreira energética.
A nucleação é um fenômeno que pode ocorrer com a formação de núcleos diretamente a partir do líquido (nucleação homogênea) ou com a formação de núcleos sobre superfícies pré-existentes (nucleação heterogênea), abordadas no material didático do portal.
Para saber mais sobre nucleação homogênea e heterogênea, acesse o material didático de fundição do CIMM.
Gostou? Então compartilhe:
