Notícias
- Material Didático
- Materiais - FundamentosSais Comuns
Como átomos de tamanho diferente se empacotam?
É muito freqüente termos dois ou mais átomos diferentes. O empacotamento é determinado pelos átomos maiores - os átomos menores tem que se encaixar nos espaços existentes! Este é o caso de muitos sais, tal como o cloreto de lítio (LiCl). O lítio é o menor dos átomos (entre todos os átomos, com exceção do hidrogênio). O "grande" cloro se empacota em uma estrutura compacta, deixando o lítio esmagado (comprimido seria o termo técnico) nos espaços octaedrais.
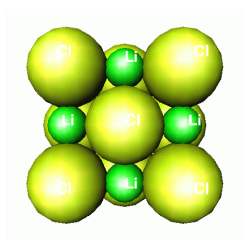
CLORETO DE LÍTIO
Por que os espaços são chamados octaedrais? Porque cada espaço ocupado por um átomo de lítio é rodeado por seis átomos de cloro, que estão nos vértices de um octaedro. Veja a figura abaixo, na qual os átomos foram desenhados como pequenas esferas a fim de enfatizar a "coordenação poliédrica". Estes conceitos geométricos são muito populares entre os estudiosos da cristalografia,uma vez que ajudam a entender a co-ordenação de átomos (o número de vizinhos mais próximos) em estruturas mais complexas, como veremos mais adiante.

ESTRUTURA OCTAEDRAL DO CLORETO DE LÍTIO
O sal de cozinha ou cloreto de sódio (NaCl) é um pouco mais democrático que o seu irmão cloreto de lítio. Os átomos de sódio são maiores e podem exercer maior influência do que os "pequenos" lítios. A estrutura do cloreto de sódio pode ser relacionada com um empacotamento cúbico de átomos, praticamente de mesmo tamanho.
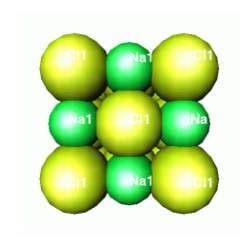
SAL DE COZINHA OU CLORETO DE SÓDIO
Gostou? Então compartilhe:
Notícias relacionadas
